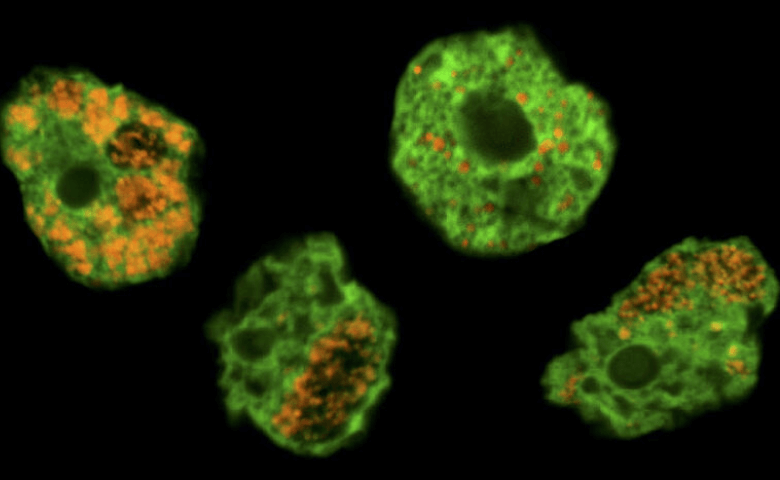
Chlamydien sind für den menschlichen Krankheitserreger Chlamydia trachomatis bekannt, aber diese Bakteriengruppe hat sich vor über einer Milliarde Jahren entwickelt – lange vor den ersten Tieren. Dennoch leben alle heute bekannten Chlamydien in einem breiten Spektrum von Wirten, von kleinen Amöben bis hin zu tierischen Zellen. Was Wissenschafter*innen jedoch seit der Sequenzierung der ersten Chlamydiengenome vor 20 Jahren vor ein Rätsel stellt, ist die Tatsache, dass Chlamydien, die Tiere infizieren, kleine Genome haben, die denen anderer Endosymbionten ähneln, während diejenigen, die Amöben infizieren, größere Genome haben, die eher freilebenden Bakterien ähneln. Die Erforschung der Evolution dieser vielfältigen Bakteriengruppe wurde jedoch dadurch erschwert, dass viele Mikroben im Labor extrem schwierig zu züchten sind.
Die Teams um Matthias Horn (Universität Wien) und Thijs Ettema (Wageningen University & Research) konnten dieses Problem umgehen: „Erst seit kurzem sind wir in der Lage, Genome direkt aus Umweltproben zu sequenzieren und die Breite der Chlamydienvielfalt zu erforschen“, erklären die Forscher*innen. Mit diesen neuen Daten untersuchten sie die Evolution der Chlamydien. Mithilfe modernster Berechnungsmethoden rekonstruierten sie, welche Gene der gemeinsame Vorfahre aller heute lebenden Chlamydien wahrscheinlich hatte. Die Mikrobiolog*innen fanden heraus, dass „er alle Gene besaß, die für einen Endosymbionten notwendig sind. Sogar Gene, die für die heutigen tierischen Chlamydien-Erreger wichtig sind, waren wahrscheinlich schon vorhanden“. Das bedeutet, dass Chlamydien seit über einer Milliarde Jahren der Evolutionsgeschichte Wirtszellen infizieren.
Zu ihrer Überraschung fanden sie jedoch auch heraus, dass Chlamydien, die Amöben infizieren, viele Stoffwechselgene erst später durch Genaustausch erwarben, obwohl Endosymbionten weniger Möglichkeiten zum Genaustausch mit anderen Bakterien haben. „Unsere Ergebnisse zeigen, dass bei einigen Chlamydien mehr Genaustausch stattgefunden hat, als für Endosymbionten erwartet wird“, erklären die Autor*innen, „einschließlich des Erwerbs wichtiger Stoffwechselgene“.
Dieses Ergebnis stellt unsere Vorstellungen von der Evolution der Endosymbionten in Frage. Aber die Forscher*innen schlagen auch eine Lösung für dieses Rätsel vor: „Es ist nicht so überraschend, wenn man sich die Umgebung ansieht, in der diese Chlamydien leben: Amöben beherbergen oft mehrere Endosymbionten und fressen Bakterien, so dass es andere Mikroben gibt, mit denen sie Gene austauschen können. Außerdem wandern die meisten Chlamydien zwischen verschiedenen Wirten hin und her und sind daher wechselnden Umgebungen ausgesetzt. Das könnte erklären, warum es für diese Endosymbionten vorteilhaft sein könnte, Stoffwechselgene zu behalten oder sogar zu gewinnen.“
Die Wissenschafter*innen sind gespannt, ob diese Art der Endosymbiontenevolution weiter verbreitet ist. In jedem Fall ist diese Studie ein wichtiger Schritt für das Verständnis der Entstehung und Entwicklung endosymbiontischer Bakterien, einschließlich menschlicher Krankheitserreger.
Publikation in Nature Microbiology:
Gene gain facilitated endosymbiotic evolution of Chlamydiae. Jennah E. Dharamshi, Stephan Köstlbacher, Max E. Schön, Astrid Collingro, Thijs J. G. Ettema, Matthias Horn. Nature Microbiology, 2023.